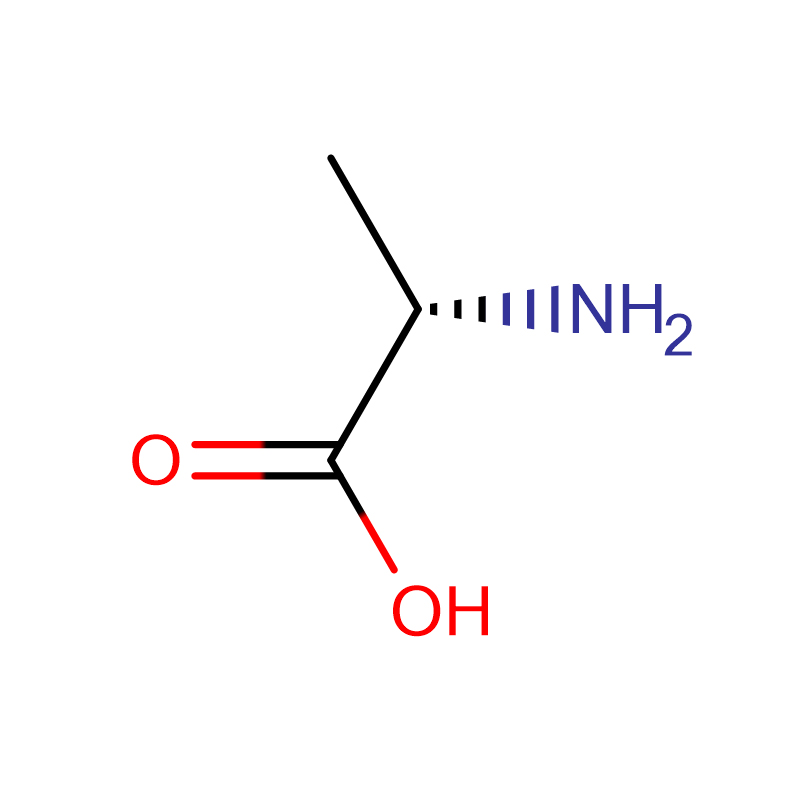
L-Alanin CAS:56-41-7 %99 Beyaz kristal toz
| Katalog numarası | XD90326 |
| Ürün adı | D-Alanin |
| CAS | 338-69-2 |
| Moleküler formül | C3H7NO2 |
| Moleküler ağırlık | 89.09 |
| Depolama Ayrıntıları | ortam |
| Uyumlaştırılmış Tarife Kodu | 29224985 |
Ürün özellikleri
| Dış görünüş | Beyaz kristal toz |
| Tahlil | %98,5 - %101,5 |
| Belirli rotasyon | +13,7 ila +15,1 |
| Ağır metaller | <%0,0015 |
| pH | 5.5 - 7 |
| SO4 | <%0,03 |
| Kurutma kaybı | <%0,2 |
| Ütü | <%0,003 |
| Ateşleme Kalıntısı | <%0,15 |
| Parçacık boyutu | 200um |
| Cl | <%0,05 |
| Kalıcı organik kirleticilerin seviyesi | kirletici yok |
γ-Glutamiltranspeptidazlar (γ-GT'ler), glutatyonun γ-glutamil amid bağını ayırır ve salınan γ-glutamil grubunu suya (hidroliz) veya akseptör amino asitlere (transpeptidasyon) aktarır.Bu her yerde bulunan enzimler, glutatyonun biyosentezi ve bozunmasında ve ksenobiyotik detoksifikasyonda önemli bir rol oynar.Burada Bacillus licheniformis γ-GT'nin (BlGT) 3Å çözünürlüklü kristal yapısını ve bunun l-Glu ile kompleksini rapor ediyoruz.X-ışını yapıları, BlGT'nin N-terminal nükleofilik hidrolaz süper ailesine ait olduğunu doğrular ve proteinin, Bacillus subtilis'ten homolog enzim için rapor edilene benzer, ancak insan γ-GT için gözlemlenenlerden farklı, açık bir aktif bölge yarığına sahip olduğunu ortaya çıkarır. diğer mikroorganizmalardan γ-GT'ler için.Veriler, l-Glu'nun bağlanmasının, BlGT büyük alt biriminin C-terminal kuyruğunun yeniden sıralanmasını indüklediğini ve bir metal iyonunun tanınmasında potansiyel olarak yer alan bir asit kalıntısı kümesinin tanımlanmasına izin verdiğini göstermektedir.Bu kalıntıların BlGT'nin konformasyonel stabilitesi üzerindeki rolü, dört yeni Ala tekli mutantının otomatik işlemesi, enzimatik aktivitesi, kimyasal ve termal denatürasyonu karakterize edilerek incelenmiştir.Sonuçlar, Asp568'in bir Ala ile değiştirilmesinin, proteinin hem otomatik işlemesini hem de yapısal stabilitesini etkilediğini göstermektedir.