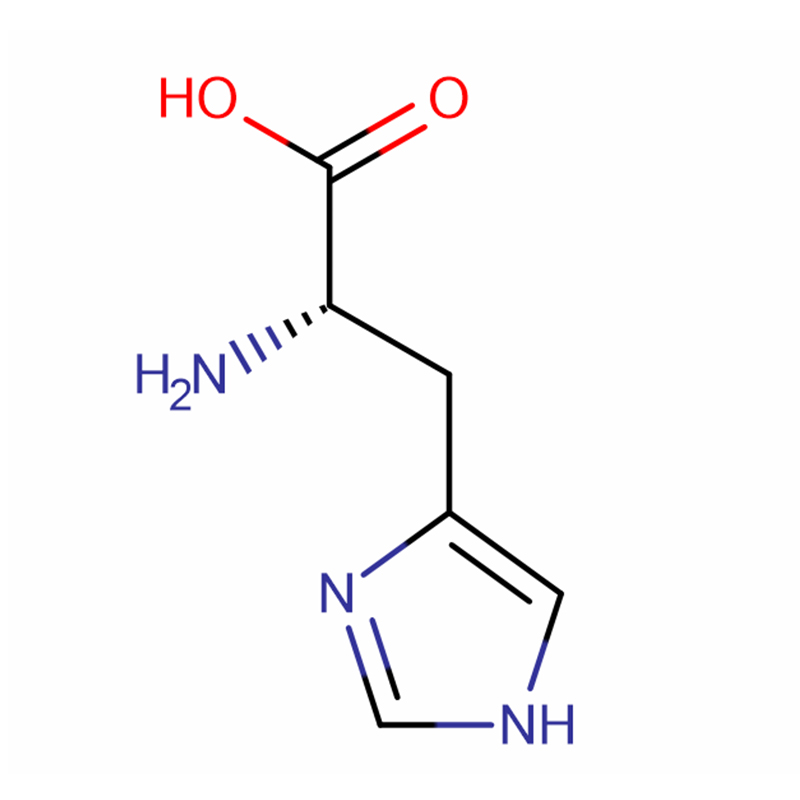
L-Histidin Cas: 71-00-1 %98,5 Beyaz kristaller veya kristal toz
| Katalog numarası | XD90301 |
| Ürün adı | L-Histidin |
| CAS | 71-00-1 |
| Moleküler formül | C6H9N3O2 |
| Moleküler ağırlık | 155.15 |
| Depolama Ayrıntıları | ortam |
| Uyumlaştırılmış Tarife Kodu | 29332990 |
Ürün özellikleri
| Tahlil | %98,5 min |
| Dış görünüş | Beyaz kristaller veya kristal toz |
| Seviye | USP39 |
| Belirli rotasyon | +12,6 ° ila +14,0 ° |
| Tanılama | Kızılötesi emilim |
| pH | 7.0 - 8.5 |
| SO4 | <=%0,03 |
| Fe | <=30ppm |
| Kurutma kaybı | <=%0,2 |
| Ateşleme Kalıntısı | <=%0,1 |
| Cl | <=%0,05 |
| Ağır metaller (PB) | <=15ppm |
| İlgili bileşikler | Herhangi bir bireysel safsızlığın %0,5'inden fazlası bulunmaz;Toplam safsızlıkların %2,0'sinden fazlası bulunmaz |
G yönünden zengin dizileri oluşturan dörtlü yapı, insan genomu boyunca eşit olmayan bir şekilde dağılmıştır.Onkojenik promotörler ve telomerlerdeki zenginleştirmeleri, bir antikanser tedavisi için G-dörtlüsü (GQ) hedefleme konusunda ilgi uyandırdı.Burada, tek molekül floresans ile ölçülen GQ oluşturan dizilerin konformasyonları ve dinamikleri hakkında nicel bir analiz sunuyoruz.Ek olarak, bu özellikleri GQ hedefleme ligandları ve G4 resolvaz 1 (G4R1) protein bağlanması ile ilişkilendiririz.Elde ettiğimiz sonuç, hem döngü (G olmayan bileşenler) uzunluğunun hem de dizinin GQ'nun uyumuna katkıda bulunduğunu göstermektedir.Gerçek zamanlı tek molekül izleri, katlanma dinamiklerinin aynı zamanda ilmek bileşimine de bağlı olduğunu ortaya koymaktadır.GQ stabilize edici küçük moleküller, N-metil mezoporfirin IX (NMM), bunun analoğu, NMP ve G4R1 proteininin seçici olarak paralel GQ konformasyonuna bağlandığını gösterdik.Bulgularımız, ilmek uzunluğu ve dizisi tarafından yönetilen GQ katlanmasının karmaşıklığına ve GQ konformasyonunun küçük molekül ve protein bağlanma eğilimini nasıl belirlediğine işaret ediyor.